Hallo,
und willkommen zum Podcast „Alles ist Chemie“, ich bin Nicholas Jankowski. Schön, dass ihr zuhört.
Das ist die dritte Folge des Podcasts, heute wird es um die Grundlagen der Chemie gehen.
Es geht um Atome und andere kleine Bestandteile, aus denen sich unsere Umwelt zusammensetzt. Die meisten werden wahrscheinlich wissen, was Atome sind. Sie wurden einst als die kleinsten Bausteine der Materie angesehen, was wie wir heute wissen, nicht stimmt. Sie sind trotzdem sehr klein und die Erforschung extrem interessant. Außerdem bauen Sie eben doch unsere Materie auf. Chemische Elemente sind durch chemische Reaktionen nicht weiter zerlegbar. Ein Verständnis von der Natur der Atome und Elemente ist daher wichtig für das Verständnis der Chemie. Dabei insbesondere die Natur der Elektronen, denn sie bilden chemische Bindungen.
Was mich an der Erforschung besonders fasziniert ist, dass Atome nicht direkt beobachtbar sind. Es gibt kein Möglichkeit mit einem klassischen Mikroskop Atome zu sehen. Es ist die Erforschung von etwas „Unsichtbaren“, also mussten viele indirekte Experimente und Wege gefunden werden. Meiner Meinung ist dieses systematische Erforschen und der Erkenntnisgewinn, woraus alles besteht eine der größten Leistungen der Menschheit und dieses Streben hält an. Die Entdeckung der Quarks in den 1960ern oder die des Higgs-Bosons, welches als bisher letztes Elementarteilchen 2012 am LHC vom CERN gefunden wurde, sind Beispiele wie wir weiter versuchen in das Unbekannte vorzudringen.
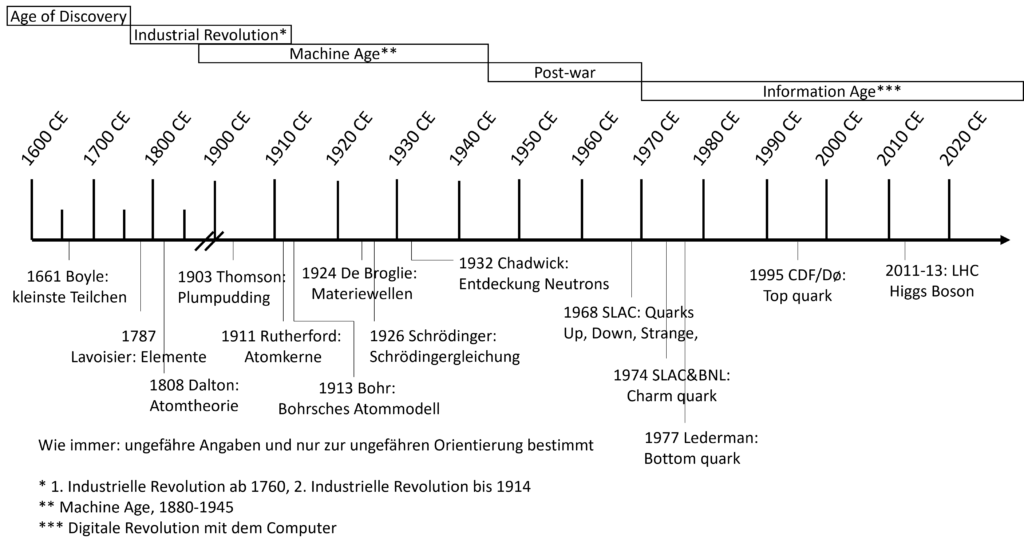
Wir beginnen mit dem geschichtlichen Hintergrund.
Bereits in der Antike und wahrscheinlich schon vorher haben sich Menschen damit beschäftigt, wie die Welt zusammengesetzt ist. In Griechenland ca. 400 Jahre vor unsere Zeitrechnung kommt unser heutiger Begriff des Atoms her. Leukipp und sein Schüler Demokrit entwarfen was wir heute als die Atomtheorie kennen. Grundlage bildet, dass alles in kleine unteilbare Teilchen zerlegt werden kann. Diese unteilbaren Teilchen wurden von ihnen „atomos“ genannt, übersetzt: nicht-spaltbar.
Diese Theorie wurde auf Basis von philosophischen Überlegungen erdacht. Für die systematische wissenschaftliche Erfoschung müssen wir einen großen Zeitsprung machen in das Jahr 1661. Dort hat Robert Boyle in seinem Buch „The Sceptical Chymist“, die Ansicht vertreten, dass die Materie aus nicht zerlegbaren Bestandteilen besteht. Zudem beschreibt er einen Unterschied zwischen Gemischen und Verbindungen, mehr dazu später. Robert Boyle gilt häufig als der erste moderne Chemiker, da er auf wissenschaftliche Prinzipien und Empirie seine Ergebnisse aufbaute.
Wir bewegen uns nun weitere 100 Jahre Richtung heute und befinden uns im Jahr 1787-1789. Antoine Lavoisier veröffentlicht eine Liste von Elementen, die nicht weiter zerlegbar sind, einige Beispiele sind Sauerstoff, Wasserstoff und Stickstoff, von denen wir heute wissen, dass sie tatsächlich Elemente sind. Fehlerhaft enthalten war zum Beispiel Ammoniak, NH3. Dieser setzt sich aus Stickstoff und Wasserstoff zusammen. Weiter Fehler waren Licht und Kalorik. Licht ist wie man heute weiß elektromagnetische Strahlung und Kalorik existiert nicht. Lavoisier hat noch viele weitere Entdeckungen gemacht und gilt verdient als Begründer der modernen Chemie.
Weiter geht es 1808 mit John Dalton und seinem Buch „A new system of chemical philosophy“, indem er die Atomhypothese beschreibt. Die besteht aus vier Aussagen:
- Stoffe bestehen aus kleinste, nicht-teilbaren kugelförmigen Teilchen, den Atomen
- Alle Atome eines Elements haben das gleiche Volumen und die gleiche Masse. Elemente unterscheiden sich durch unterschiedliche Massen/Volumina.
- Atome sind unzerstörbar. Sie können durch chem. Reaktionen nicht vernichtet oder erzeugt werden.
- Chemische Reaktionen ordnen Atome in Verbindungen neu an.
Die Liste ist zitiert nach Wikipedia, ich habe ins Original geschaut und da steht es, aber sehr verklausuliert.
Dadrin steckt schon viel Wahres und es ist tatsächlich so, dass durch chemische Reaktionen ein Element nicht verändert werden kann. Aber das Atom an sich wird zweifellos verändert, denn die Abgabe oder Aufnahme eines Elektrons kommt durchaus vor. Davon wusste er allerdings noch nichts.
Wir bewegen uns weitere 100 Jahre Richtung Gegenwart von 1808 nach 1903. Joseph John Thomson entwickelt das Plumpudding-Modell oder Rosinenkuchen-Modell. Manch einer nennt es auch nach ihm.Thomson model (Wikipedia)
Er konnte zuvor nachweisen, dass Elektronen als Teilchen existieren und eine deutlich geringere Masse als Atome haben. In seinem Atommodell sind Elektronen als kleine negativ geladene Teilchen in einem großen positiven Feld ohne Masse verteilt. Ungünstigerweise würde das schon 1837 Elektronen im Wasserstoffatom benötigen. Die Elektronen sollten zufällig wie Rosinen im Kuchen verteilt sein. Diese Erkenntnis war bahnbrechend, da nun kleinere Bestandteile von Atomen bekannt waren.
Jetzt geht es auch Schlag auf Schlag, wir machen weiter nur 8 Jahre später, 1911. Das Rutherford-Modell (Wikipedia) benannt nach Ernest Rutherford. Er und seine Mitarbeiter fanden heraus, dass sogenannte Alpha-Teilchen beim Bestrahlen von dünnen Folien zurückgeworfen werden können. Das war sehr unerwartet, denn durch die kleinen Elektronen hätte das nicht passieren dürfen, oder um es in den Worten von Rutherford zu sagen:
„Es war beinahe so unglaublich, als ob man mit einem 15-Zoll-Geschoss auf ein Taschentuch schießt und das Geschoss zurückkommt und einen selbst trifft.“
Die Schlussfolgerung war, dass es einen Atomkern geben müsste. In diesem sei die positive Ladung konzentriert. Die Elektronen seien zufällig darum verteilt und entsprechen in ihrer Anzahl der Anzahl positiver Ladung im Kern. Die Masse verteile sich auf beide Bestandteile.
Von 1911 nach 1913 und wir sind beim wohl bekanntesten Atommodell: Dem Bohrschen Atommodell (Wikipedia) benannt nach Niels Bohr. Ändern tut sich wenig könnte man meinen, denn zunächst war die wesentliche Änderung „nur“, dass Elektronen auf Bahnen um den positiven Kern kreisen. Damit waren jetzt Energieniveaus im Modell enthalten. Rückblick zur letzten Folge, die Energieniveaus durch die es charakteristische Leuchterscheinungen in Flammen gibt.
Dennoch ist das Modell physikalisch Quatsch, da die Bewegung Energie abstrahlen müsste. Das war damals übrigens auch schon bekannt. Dennoch ist das Modell eine super eingängliche Vereinfachung. Und wie es George Box gesagt hat:
„Alle Modelle sind falsch, aber einige sind nützlich.“
Die Stärken des Modells liegen für mich eindeutig in der Einfachheit, mit der es zu verstehen ist und der verhältnismäßig hohe Informationsgehalt.
Man hat durch das Modell einen Zugang zur Ordnung in Atomen, welche sich auf das Periodensystem übertragen lässt und man kann anhand der äußersten Elektronenschale, der Valenzschale, die Reaktivität abschätzen. Dies gilt zumindest für die ersten drei Perioden des Periodensystems, also den Elementen Wasserstoff bis Argon und dazu die ersten beiden aus der vierten Reihe Kalium und Calcium. Danach wird es schwierig und die Fehler nicht mehr zu ignorieren, meiner Meinung nach.
Fünfzehn Jahre später, 1928, wird das Modell ausgearbeitet, welches bis heute Bestand hat: Das Atomorbital-Modell. (Wikipedia)
Es beginnt mit den Erkenntnissen von Louis de Broglie, der den Wellencharakter des Elektrons 1924 in seiner Doktorarbeit beschreibt. Er konnte feststellen, dass sich Materie wie die Elektronen auch wie Wellen verhalten können und erweiterte damit den Welle-Teilchen-Dualismus auf Materie.
Daraus abgeleitet konnte Erwin Schrödinger 1926 die nach ihm benannte Schrödinger-Gleichung aufstellen. Die das Verhalten von physikalischen Systemen als Wellenfunktion darstellt. Diese Form der Beschreibung hat sich gegen die Matrizenbeschreibung von Werner Heisenberg, Max Born und Pascual Jordan durchgesetzt.
Doch was macht die Schrödingergleichung jetzt? Mit ihr ist es möglich Elektronen eines Atoms zu beschreiben. Das Atomorbital ist die Wellenfunktion, also Schrödingergleichung, eines Elektrons in einem Atom. Dadurch wird Ort und Wellencharakter eines Elektrons beschrieben.
Ein Problem, welches aus daraus folgt, ist die Heisenbergsche Unschärferelation. Kurz zusammengefasst und dass was die meisten damit verbinden ist, dass der Ort und Impuls eines Teilchens nicht gleichzeitig bestimmt werden können.
Max Born indes postulierte, dass die quadrierte Wellenfunktion die Aufenthaltswahrscheinlichkeit angibt.
Was wir heute häufig als Orbitale bezeichnen, sind Darstellungen, die von dieser Aufenthaltswahrscheinlichkeit abgeleitet sind. Sie geben nie 100% Wahrscheinlichkeit wieder, sondern häufig 90-95%. 100% wäre eine unendliche Ausdehnung.
Viele, viele Wissenschaftler haben auf dem Weg zum heutigen Verständnis der Welt Nobelpreise bekommen, so fast alle die ich heute erwähnt habe und die in der Zeit des Preises noch lebten.
Ein kleiner Teil fehlt noch für unser Verständnis des Atoms: das Neutron. 1932 von James Chadwick entdeckt, hat dieser ebenfalls einen Nobelpreis bekommen.
Und damit verlassen wir die Geschichte und widmen uns der physikalisch-chemischen Natur.
Wir beginnen mit dem Aufbau der Atome, gehen über zu Molekülen, erklären Verbindungen und Gemische.
Also zu den Atomen.
Nach unserem Kenntnisstand bestehen Atome aus einem Atomkern und den Elektronen in einer „Wolke“ drumherum.
Im Kern befinden sich Protonen und Neutronen. Protonen sind einfach elektrisch positiv geladen. Neutronen sind ungeladen, daher Neutron von neutral.
Die Masse des Atoms ist fast vollständig im Kern zu finden, dabei sind ein Proton und ein Neutron ungefähr gleichschwer, ca. 1 u oder Dalton; was die atomare Masseneinheit ist. Sie unterscheiden sich erst in der dritten Nachkommastelle. Ausgehend von der Anzahl der Protonen werden die Elemente bestimmt. So ist ein Atom mit einem Proton ein Wasserstoffatom, mit zwei Protonen ein Heliumatom, mit drei ein Lithiumatom und so weiter bis derzeit 118 Oganesson.
Im elementaren Zustand hat ein Atom gleich viele Elektronen wie Protonen, mehr zu den Elektronen später, wir bleiben noch beim Atomkern. In diesem sind auch noch die Neutronen, welche mit dafür verantwortlich sind, ob ein Kern stabil ist oder nicht.
Protonen sind ja einfach positiv geladen, das heißt, wenn immer mehr im Kern zusammenkommen, würden sie sich irgendwann abstoßen, ganz wie Magneten es tun. Alle Kerne über dem Wasserstoffkern mit nur einem Proton benötigen Neutronen um stabil zu sein. Die Anzahl der Neutronen kann variieren, und diese unterschiedliche Anzahl definiert die Isotope eines Elements. Nochmal kurz zusammengefasst: Ein Element wird durch die Anzahl der Protonen charakterisiert. Wasserstoff zum Beispiel ein Proton. Die Isotope durch unterschiedlich viele Neutronen. So gibt es von Wasserstoff drei relevante Isotope: Protium, Deuterium und Tritium. Protium hat kein Neutron und ist das bei weitem häufigste Isotop bzw. Wasserstoffatom. Deuterium hat ein Neutron und Tritium hat zwei Neutronen.
Die ersten beiden Protium und Deuterium sind stabil, aber im Tritium sind zu viele Neutronen enthalten, sodass dieser Kern zerfällt. Was bedeutet, dass er radioaktiv ist. Die Instabilität eines Isotops hängt von der Anzahl der Neutronen ab, dabei sind sowohl zu wenige wie zu viele Neutronen schlecht, es muss schon die genau richtige Menge sein. So sind denn auch nur 251 von 3383 Isotope stabil. Radioaktivität ist ein sehr spannendes und großes Thema, was bestimmt noch vertieft werden wird. Wir machen jetzt mit den Elektronen weiter, die für die Chemie besonders interessant sind.
Wie bereits gesagt, im elementaren Zustand eines Atoms sind gleich viele Protonen und Elektronen vorhanden. Die Elektronen sind deutlich leichter als Protonen oder Neutronen, sie wiegen ca 0,0005u oder anders ausgedrückt nur ca. 1/2000tel. Sie umgeben den Kern in Orbitalen. Die nach bestimmten Regeln besetzt werden, die „Regeln“ spiegeln energetisch günstige Konstellationen wieder. Anders ausgedrückt, die Natur ist bestrebt einen möglichst energiearmen Zustand zu erreichen. Es ist eben einfacher im Zug zu sitzen als zu stehen.
Die Orbitale nehmen verschiedene Formen an und können jeweils 2 Elektronen beherbergen. Wir bewegen uns jetzt einmal durch die jeweils einfachsten Formen. Die sogenannten 1s, 2p, 3d, 4f Orbitale. Diese sind auch einfach im Periodensystem der Elemente abzulesen. Wer es jetzt nicht vorm inneren Auge hat, dem würde es helfen sich das für den nächsten Abschnitt anzuschauen.
Wir sehen im Periodensystem der Elemente, kurz PSE, Spalten, auch Gruppen genannt, und Zeilen, die Perioden genannt werden. Die Elemente sind so angeordnet, dass Elemente mit der gleichen Anzahl an Valenzelektronen untereinander in den Spalten oder Gruppen stehen. Elemente, die in einer Zeile oder Periode stehen bekommen von links nach rechts jeweils eine Elektron (und Proton) hinzu. Im Allgemeinen haben Elemente einer Gruppe mit der gleichen Anzahl Valenzelektronen ähnliche Eigenschaften. Zum Beispiel versucht man derzeit Lithium in Lithium-Ionen-Batterien durch Natrium zu ersetzen, welches direkt darunter steht. Sie verhalten sich ähnlich, unterscheiden sich jedoch, weshalb das ein aktuelles Forschungsthema ist. Problematisch ist unter anderem, dass Natrium deutlich größer ist und daher weniger Energie im gleichen Volumen speichern kann.
Eine Periode gibt die äußerste Elektronen-Schale wieder. Generell versuchen Elemente nach Möglichkeit ihre Schale bzw. Periode mit Elektronen zu füllen und damit die sogenannte Edelgaskonfiguration zu erfüllen. Für die erste Periode sind 2 Elektronen nötig, zweite und dritte Periode jeweils 8 Elektronen, vierte und fünfte jeweils 18 Elektronen und für die weiteren 32.
Schlagen wir erneut einen Bogen zu den Orbitalen, in der englischen Wikipedia ist das Element zudem farblich eingeteilt in s, f, d und p-Block, korrespondierend mit dem jeweils höchsten besetzten Orbital.
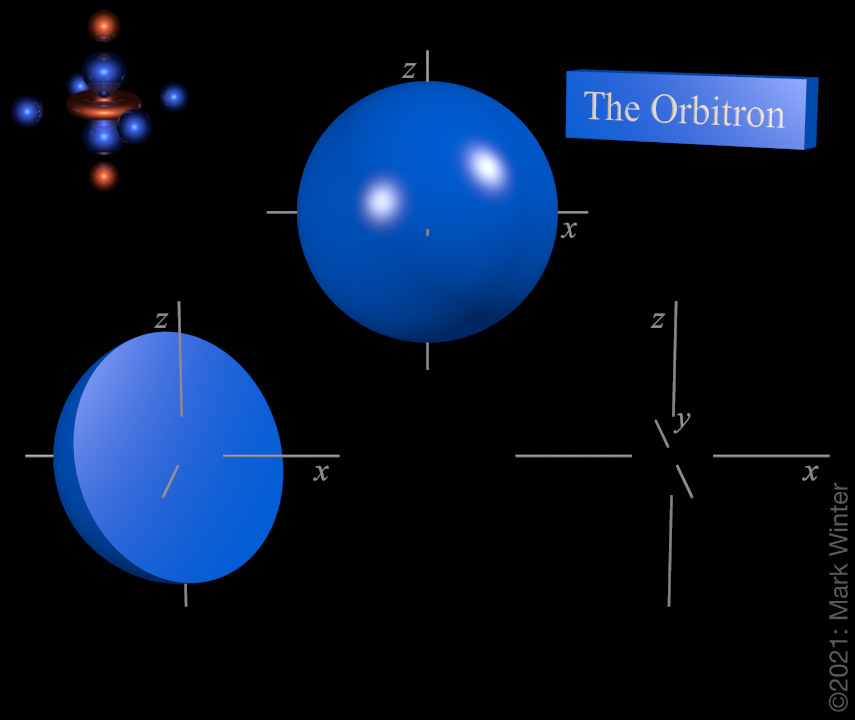
Die ersten beiden Gruppen sind der s-Block. Das bedeutet, dass sie ein s-Orbital füllen. Zwei Gruppen, da es nur ein Orbital ist und Orbitale maximal 2 Elektronen aufnehmen können. Das erste s-Orbital ist das 1s-Orbital, 1 von der ersten Schale. Es nimmt die Gestalt einer Kugel an. Die dazu gehörigen Elemente sind Wasserstoff und Helium. Helium stellt allerdings eine Besonderheit dar, denn Helium ist auch ein Edelgas, da die Schale komplett gefüllt ist. Daher wird es nach Konvention der letzten Gruppe 18 zugeschrieben.
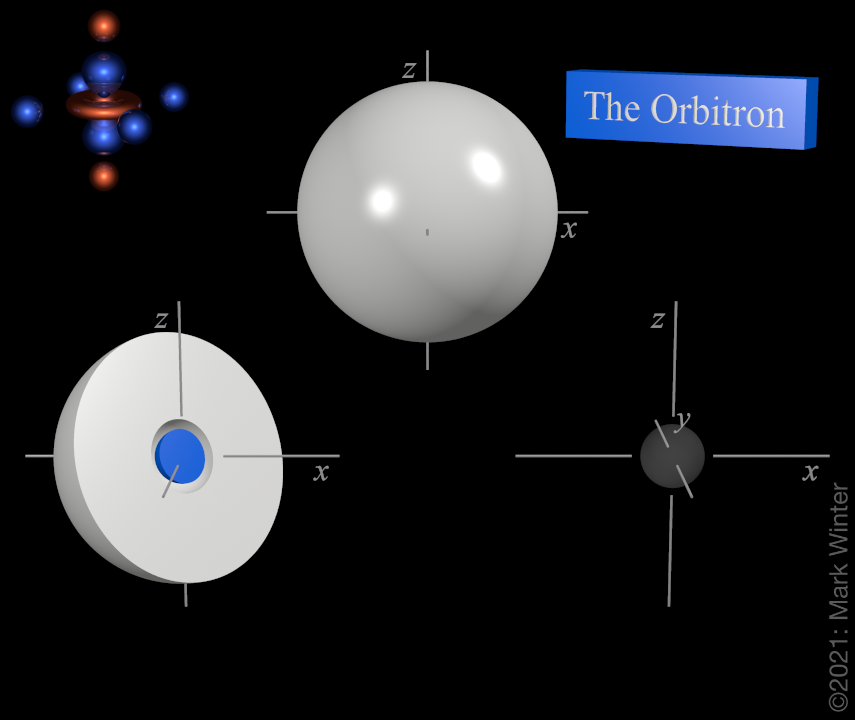
Wir gehen weiter im Periodensystem und sehen im s-Block der zweiten Periode Lithium und Beryllium. Diese füllen das 2s-Orbital. Das hat nach Außen ebenfalls die Gestalt einer Kugel, aber im Innern ist ein Bereich, an dem sich kein Elektron aufhalten kann bzw. die Wahrscheinlichkeit gleich 0 ist, dieser Bereich nennt sich auch Knoten. Wer sich dafür interessiert kann sich das mal auf The Orbitron anschauen oder im Blog auf allesistchemie.de, beides verlinkt in den Shownotes. Geht man weiter nach unten im PSE, so ist es dann das 3s-Orbital für Natrium und Magnesium, dann das 4s für Kalium und Calcium und so weiter. Und jedes Mal kommt einer dieser Knoten hinzu, das gilt auch für alle anderen Typen von Orbitalen.

Wir machen allerdings weiter nach dem 2s. Zur Erinnerung: wir sind in der 2. Periode und hatten gerade die Elektronen von Lithium und Beryllium ins 2s-Orbital gesteckt. Als nächstes kommt der p-Block mit den Gruppen 13 bis 18. In der zweiten Periode sind das die Elemente Bor, Kohlenstoff, Stickstoff, Sauerstoff, Fluor und Neon.
Ab der zweiten Periode kommen die 2p-Orbitale hinzu. Davon gibt es insgesamt drei, sodass 6 Elektronen hineinpassen. Sie nehmen die Form von Hanteln an, die sich jeweils in eine Raumrichtung erstrecken. Sie stehen im 90°-Winkel zueinander und bilden damit quasi einen Stern jeweils in den Raumrichtungen x, y, z. Sind die p-Orbitale komplett gefüllt, dann ist man in Gruppe 18, die Edelgase. Edel da man früher annahm, dass sie keine chemischen Reaktionen eingehen. Auch heute gibt es nur, vergleichsweise, wenige Reaktionen mit Ihnen.
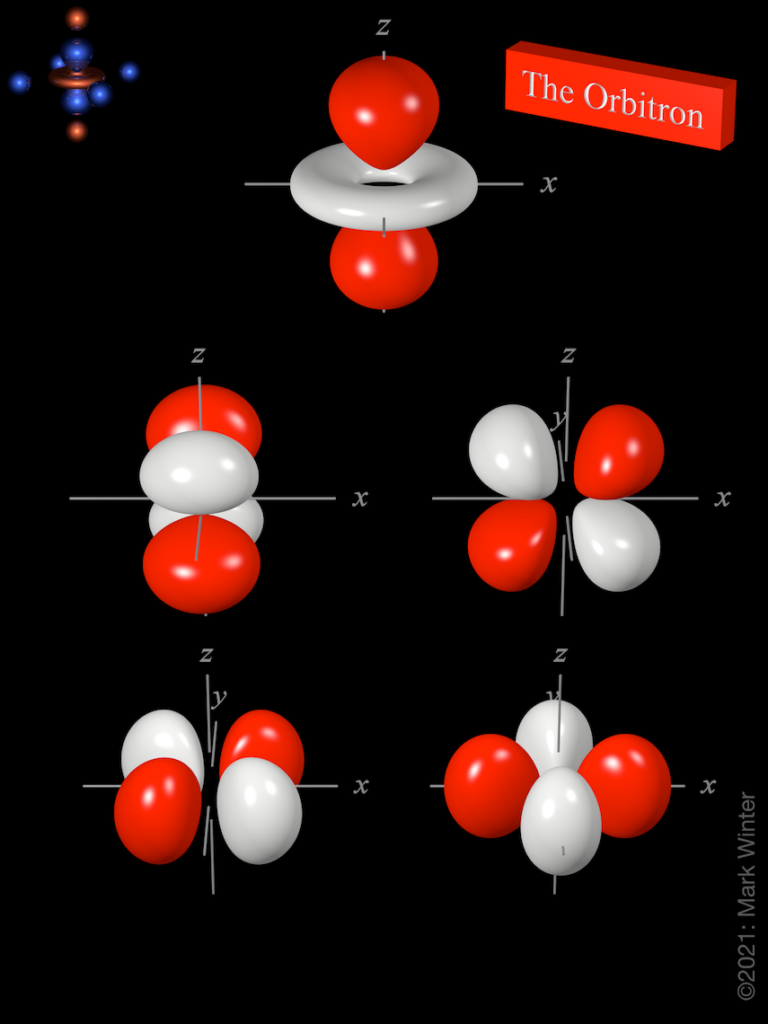
Wir gehen weiter und finden uns in der 3. Periode, da kommen dann auch die d-Orbital hinzu, aber wie man auch im Periodensystem sieht, werden sie noch nicht besetzt. Denn da stehen keine Elemente im d-Block. Dennoch existieren die 3d-Orbitale bereits, doch sie haben höhere Energien und werden erst nach den 4s-Orbitalen der 4. Periode gefüllt. Dort beginnen dann die d-Block-Elemente, welche allesamt Metalle sind. Bekannt vor allem natürlich Eisen, Silber, Gold, Platin, Kupfer und noch viele weitere. 3d-Orbitale gibt es an der Zahl fünf, sodass 10 Elektronen Platz finden. 4 von den Orbitalen sehen aus wie vier-blättrige Kleeblätter, eines sieht aus wie eine Hantel mit einem Ring um die Mitte.

Die letzte bekannte Art von Orbitalen sind die f-Orbitale, diese starten mit den 4f-Orbitalen, aber werden erst mit der 6. Periode gefüllt, auch hier wie schon zu vor, weil sie in ihrer Energie zu hoch liegen.
Die Elemente, die im f-Block sind die Lanthanoide und Actinoide. Die bekanntesten Elemente wahrscheinlich Neodym, von den starken Magneten, und Uran von der Kernspaltung und deren Anwendung. Es gibt jeweils 14 Lanthanoide und Actinoide, und dazu passend auch 7 f-Orbitale. Wie gesagt das erste sind die die 4f-Orbitale. Diesmal sind es 4 verschiedene Formen und ehrlich gesagt fehlt mir die Phantasie sie sinnvoll zu beschreiben.
Wir haben den Aufbau der Atome und Elemente damit erstmal abgeschlossen, weiter geht’s mit dem Aufbau von Verbindungen. Dabei sind drei Arten von Bindungen entscheidend: ionische und kovalente Bindungen, sowie Metallbindungen. Jede dieser Bindungen führt zu anderen Eigenschaften der Verbindungen.
Eine typische ionische Bindung liegt beim Kochsalz vor. Dieses besteht aus einer 1:1 Mischung von Natrium und Chlor-Atomen. Diese liegen allerdings nicht mehr elementar vor, sondern in Form von Ionen. Natrium gibt ein Elektron ab und wird dadurch zum Kation, das einfach positiv geladen ist. Das Chloratom nimmt ein Elektron auf und wird dadurch zum Anion, das einfach negativ geladen ist. Die Anziehung zwischen positiver und negativer Ladung führt zur Bindung. Dabei wirkt die Ladung in alle Raumrichtungen gleich, also ungerichtet, weswegen sie sich mit der jeweils anderen Ladung umgeben und ein Gitter bilden.
Bei kovalenten Bindungen werden die Elektronen nicht den Partnern zugeordnet. Sie teilen sich dagegen die Elektronen. Beispiele sind Verbindungen aus dem Element, zum Beispiel das Stickstoff-Molekül in der normalen Luft: N2. Ein weiteres Beispiel sind die Hauptbestandteile von Holz: Cellulose, Hemicellulose und Lignin. Bei dieser Bindungsart müssen die Orbitale der Atome sich überlappen und so die Bindung bilden. Man spricht davon, dass die Bindung gerichtet ist. Was letztendlich bedeutet, dass bestimmte Atome aneinanderhängen.
Die kovalente und ionische Bindungen hängen trotz ihrer Unterschiede zusammen. Der Übergang zwischen beiden ist fließend und häufig können Bindungen Charakteristika beider Arten zeigen.
Wir kommen zur letzten Bindung: der metallischen Bindung. Im Prinzip kann man dort schon einmal von einer kovalenten Bindung ausgehen, denn erstmal sind es ja Bindungen unter den gleichen Atomen. Was allerdings passiert ist, dass alle Metallatome sich in unendlicher Ausdehnung binden. Sie bilden die sogenannten Atomrümpfe, gleichzeitig sind die Elektronen über all jene Atomrümpfe delokalisiert. Das bedeutet, dass alle Valenzorbitale der Metallatome miteinander wechselwirken. Die Elektronen sind nicht mehr an einem oder zwischen zwei Atomen, sondern über alle verteilt. Im Mittel natürlich eines bei jedem Metall, aber eben nicht festgeschrieben. Typische Metallbindungen sind natürlich in den Metallen zu finden, Kupfer, Stahl oder Gold zum Beispiel.
Alle drei Arten von Bindungen führen zu chemischen Verbindungen, davon sind aber nicht alle Moleküle. Moleküle sind nur diese Verbindungen, die durch kovalente Bindungen gebildet werden und keine unendliche Ausdehnung besitzen können, sondern definiert vorliegen.
Das sind nun die Elemente und ihre Verbindungen oder auch Reinstoffe. Daneben können diese auch gemischt Vorkommen. Der Fachbegriff ist dafür denkbar einfach: es sind Gemische.
Gemische sind für die Gesellschaft hochrelevant, da die meisten Stoffe, die wir einsetzen wollen, nur in Gemischen richtig funktionieren. Sei es ein Arzneimittel, das in Tablettenform genommen wird oder ein Haarspray, das noch pflegende Inhaltsstoffe und Treibmittel enthält. Ein wesentlicher Anteil an der Produktentwicklung ist daher die Formulierung, die dafür sorgt, dass ein aktiver Wirkstoff auch das tun kann, was er soll.
Fassen wir die heutige Folge zusammen:
Wir haben uns heute mit den Grundlagen der Chemie beschäftigt. Genauer mit dem Aufbau der Materie. Ein Stoff kann entweder ein Reinstoff oder ein Gemisch sein, dabei setzen sich die Reinstoffe aus Elemente und/oder Verbindungen zusammen. Elemente sind Atome, die sich zu Verbindungen, nun ja verbinden können.
Die Atome setzen sich Protonen, Neutronen und Elektronen zusammen. Dabei befinden sich die Protonen und Neutronen im Kern und die Elektronen umgeben diesen. Die Anzahl der Protonen legt fest welches Element vorliegt, mit einem Proton haben wir zum Beispiel Wasserstoff vor uns. Eine unterschiedliche Anzahl an Neutronen im Kern führt zu Isotopen. Im elementaren Zustand sind genauso viele Elektronen wie Protonen vorhanden, sodass das Atom nach außen neutral ist. Atome können aber auch Elektronen abgeben oder aufnehmen, dann werden sie zu Ionen. Kationen sind positiv geladen, Anionen negativ.
Die äußersten Elektronen, die sogenannten Valenzelektronen, sind entscheidend für die Ausbildung chemischer Bindungen. Elemente streben danach die sogenannte Edelgaskonfiguration, d.h. volle Elektronenschalen zu erreichen. Das heutige Atom-Modell ist auf quantenmechanischen Überlegungen und Berechnungen aufgebaut. Die Elektronen finden dabei ihren Platz in den sogenannten Orbitalen. Die je nach Energie andere Formen annehmen.
Wir haben drei Arten von chemischen Bindungen besprochen:
Ionische Verbindungen setzen sich aus Ionen zusammen, sodass formal einem Partner ein Elektron genommen und dem anderen hinzugefügt wird.
Atome, die durch kovalente Bindungen verbunden sind, teilen sich ihre Elektronen. Wenn es nicht zwei Atome des gleichen Elements sind, dann zieht ein Partner die Elektronen etwas näher zu sich als der andere. Daher ist der Übergang fließend zur ionischen Bindung und beide können anteilig den Charakter von Bindungen beschreiben.
Zudem haben wir noch Metalle besprochen, das interessante ist, dass sich die Elektronen nicht mehr nur zwischen zwei Atomen aufhalten, sondern über alle verteilt sind.
Das war für eine Folge glaube ich ziemlich viel Information auf einmal, ich hoffe ihr hattet trotzdem Spaß und habt durchgehalten. Nächstes Mal geht es wieder in die Geschichte.
Damit sind wir am Ende der Folge. Das Skript zum nachlesen, inklusive Bilder, weiterführende Links und einen Zeitstrahl findet ihr auf der Website: allesistchemie.de, zusammengeschrieben ohne Leerzeichen.
Wenn ihr Feedback oder Anregungen habt könnt ihr da einen Kommentar hinterlassen oder eine Email schreiben an info@allesistchemie.de.
Das war Alles ist Chemie Folge Nr 3. Ich bin Nicholas Jankowski, danke fürs Zuhören.
Quellen:
Latscha 2011: Allgemeine Chemie Basiswissen I; https://d-nb.info/1009310542
A list of 33 simple substances compiled by Lavoisier, from Traité Élémentaire de Chimie, Cuchet, Paris, 1789, p. 192; https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=3
Huheey1993 – Anorganische Chemie; https://d-nb.info/1239057024
Klett: Das Orbitalmodell; https://www2.klett.de/sixcms/media.php/229/756123_0000.pdf
The Orbitron: Atomorbitale im Web; https://winter.group.shef.ac.uk/orbitron/
Liste der Isotope/Discovery of Nuclides Project; https://people.nscl.msu.edu/~thoennes/isotopes/index.html
32-elektronen-Regel
https://iramis.cea.fr/en/Phocea/Vie_des_labos/Ast/ast.php?t=fait_marquant&id_ast=1157
Unterstützende Wikipedia-Seiten:
https://en.wikipedia.org/wiki/Atom
https://de.wikipedia.org/wiki/Liste_der_Atommodelle
https://de.wikipedia.org/wiki/Welle-Teilchen-Dualismus
https://de.wikipedia.org/wiki/Schr%C3%B6dingergleichung
https://en.wikipedia.org/wiki/Periodic_table
https://en.wikipedia.org/wiki/Robert_Boyle
https://en.wikipedia.org/wiki/Antoine_Lavoisier
https://en.wikipedia.org/wiki/John_Dalton
https://en.wikipedia.org/wiki/J._J._Thomson
https://en.wikipedia.org/wiki/Ernest_Rutherford
https://en.wikipedia.org/wiki/Niels_Bohr
https://en.wikipedia.org/wiki/Louis_de_Broglie
https://en.wikipedia.org/wiki/Erwin_Schr%C3%B6dinger
https://en.wikipedia.org/wiki/Werner_Heisenberg
https://en.wikipedia.org/wiki/Max_Born
https://en.wikipedia.org/wiki/James_Chadwick
https://en.wikipedia.org/wiki/Robert_S._Mulliken
https://en.wikipedia.org/wiki/Wolfgang_Pauli
https://en.wikipedia.org/wiki/Linus_Pauling
https://en.wikipedia.org/wiki/Friedrich_Hund
Assoziationen:
- Formulierung
- Aktive Wirkstoffe
- Metalle und Legierungen
- Leiter, Halbleiter, Isolatoren
- Salze
- Die Elemente und das Periodensystem 2
- Elemente in depth